ADHはなぜ分泌されるか
抗利尿ホルモンであるADH(アルギニン・バソプレシン:AVP)は、主に体内の水分量と浸透圧を一定に保つために視床下部で作られ、下垂体後葉から分泌されます。主な分泌刺激は以下の通りです。
血漿浸透圧の上昇(浸透圧性調節)
- 最も主要な調節因子です。血液脳関門の外側に位置するOVLT(終板脈管器官)とSFO(脳弓下器官)がセンサーとして働き、血漿浸透圧の上昇や血中のアンジオテンシンIIの増加を直接感知します。これらの部位で感知された情報はMnPO(正中視索前核)へと送られ、MnPOはこの情報を統合して「渇き(飲水)」を誘発する信号を出すと同時に、PVH(視床下部室傍核)や視索上核にある神経内分泌ニューロンへ興奮性の信号を送ります。
- この指令を受けたPVHのニューロンはADH(図中ではVP)を合成し、その軸索が伸びている下垂体後葉からADHを血流中に放出させ、最終的にVPが腎臓での水分の再吸収を促進(水排泄を抑制)することで体内の水分量を増やし、血漿浸透圧を低下させます。
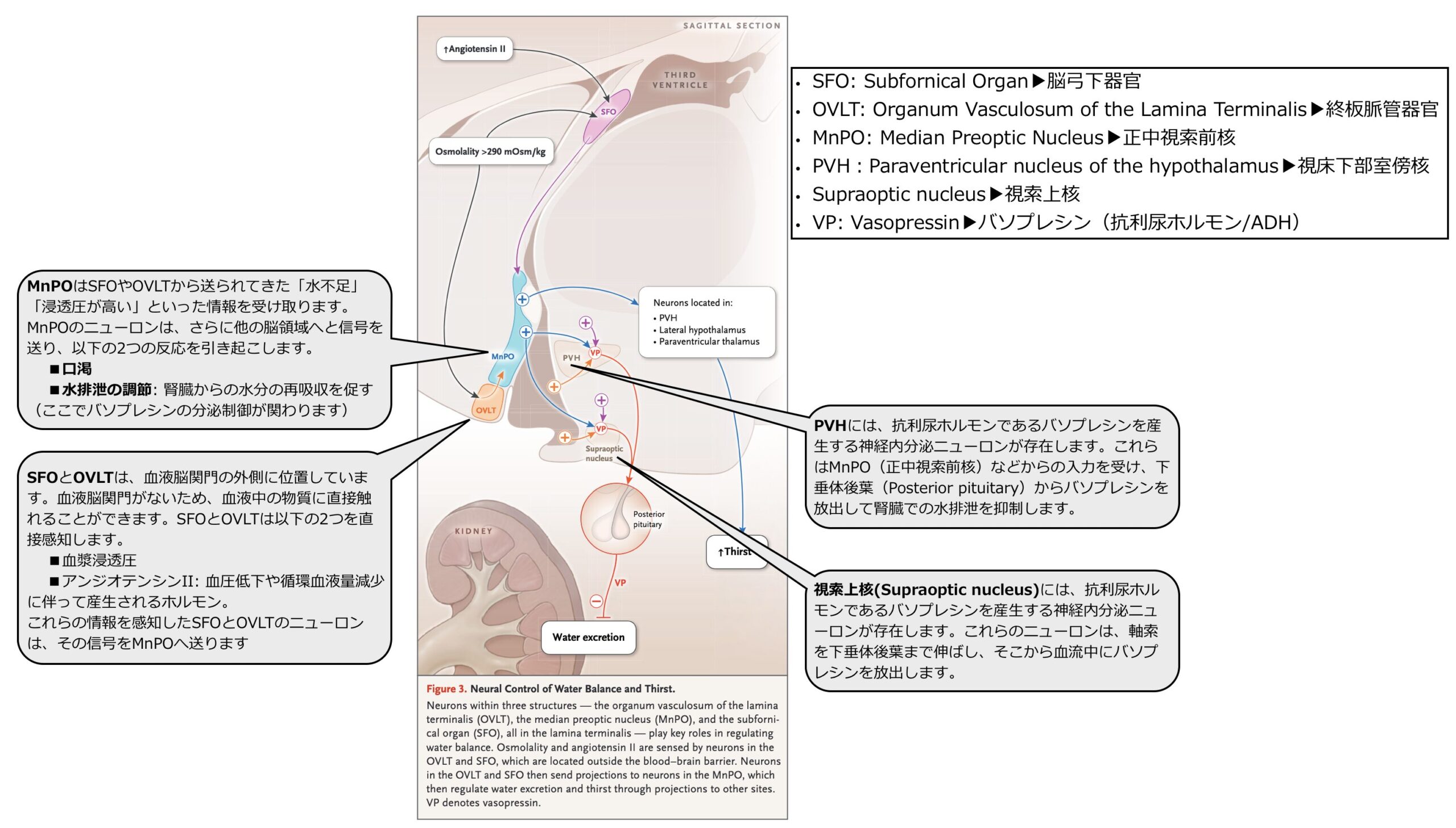
循環血液量や血圧の低下(非浸透圧性調節)
- 出血や脱水などで有効循環血液量が減少したり、血圧が低下したりすると、心房にある容量受容体(低圧系圧受容体)や頸動脈・大動脈弓にある圧受容体(高圧系圧受容体)がそれを感知し、ADH分泌を強く刺激します。この反応は、循環動態を維持するための緊急反応としての側面があります。
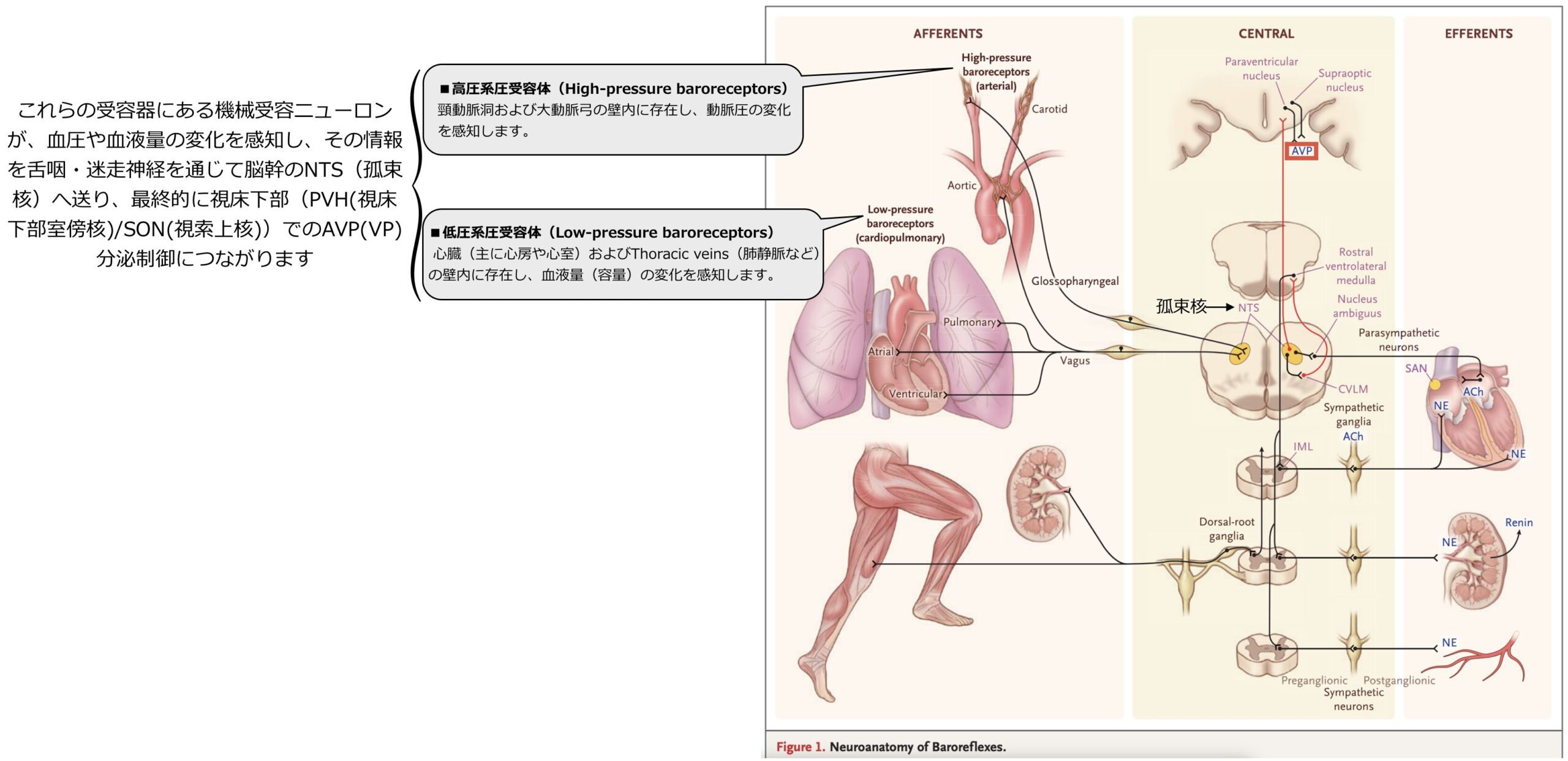
その他の非浸透圧性刺激
- 悪心(吐き気)、痛み、ストレス、低酸素血症、低血糖、周術期の侵襲なども強力なADH分泌刺激となります。
- これらは、血液量や浸透圧の変化がなくてもADHを分泌させることがあります。
ADHが分泌亢進する疾患や病態
ADHの分泌が亢進する状態には、生理的な反応によるものと、不適切に分泌される病的なものがあります。
- 有効循環血液量が減少する病態(生理的反応)
- 循環血液量減少性ショック・脱水: 出血、下痢、利尿薬の使用などにより体液が失われた場合。
- 浮腫性疾患(ハイパーボレミアだが有効血流量は低下): 心不全、肝硬変(腹水貯留)、ネフローゼ症候群など。これらは体全体の水分量は過剰ですが、血管内の有効な血液量が減少していると身体が感知するため、ADH分泌が亢進します。▶詳しくは下記。
- ADH不適切分泌症候群(SIADH)
- 低浸透圧であるにもかかわらず、ADHが抑制されずに分泌され続ける病態です。またいずれ別記事にまとめようと思います。
- 原因: 悪性腫瘍(肺小細胞癌など)、中枢神経疾患(脳卒中、外傷など)、肺疾患(肺炎、結核など)、薬剤(抗うつ薬、抗てんかん薬など)。
- その他の内分泌疾患
- 副腎皮質機能低下症(コルチゾール欠乏)や重度の甲状腺機能低下症でも、ADH分泌の抑制が効かなくなり分泌が亢進することがあります。
- 胸腔内圧の上昇を伴う病態
- 気胸、胸水、人工呼吸器管理(PEEPなど)、気腹(腹腔鏡手術などによる横隔膜挙上)などが該当します。
- 胸腔内圧が上昇するとなぜADHが分泌するかについて疑問に思ったため調べました↓
胸腔内圧が上昇するとなぜADHが分泌するのか
Solis-Herruzo JA, Moreno D, Gonzalez A, Larrodera L, Castellano G, Gutierrez J, Gozalo A. Effect of intrathoracic pressure on plasma arginine vasopressin levels. Gastroenterology. 1991 Sep;101(3):607-17. に記載されていたので紹介します。
- 胸腔内圧の上昇がADH分泌を引き起こす主なメカニズムは、心房の伸展刺激の減少によるものです。
- 実際に、気胸や胸水、気腹によって胸腔内圧が上昇している患者ではADHレベルが著しく上昇し、治療(脱気や排液)によって胸腔内圧を下げるとADHレベルが低下することが報告されています。
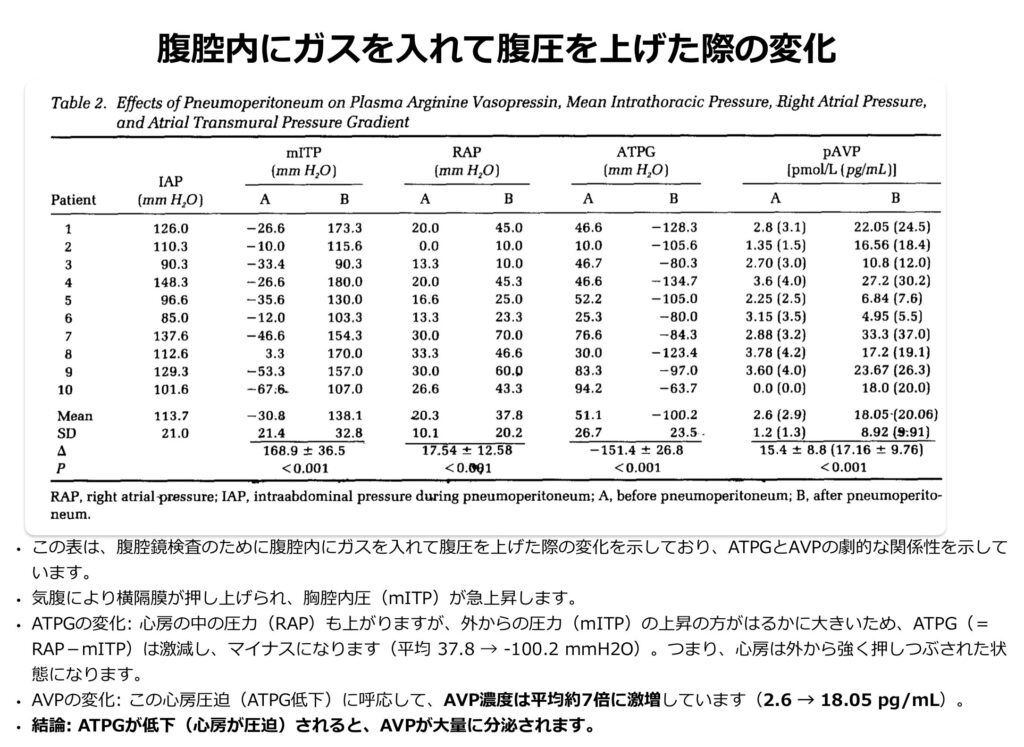
1. 心房経壁圧較差(ATPG)の低下
- 胸腔内圧が上昇すると、心臓の周囲の圧力が上がります。これにより、心房内圧と胸腔内圧の差である「心房経壁圧較差(Atrial Transmural Pressure Gradient)」が減少します(ちなみに”心房経壁圧較差”という日本語にしてみましたが合っているかは不明です。。。。すみません)。ATPGは私も知らない概念で以下の計算式で算出するようです。
- ATPG=右房圧 (RAP)−平均胸腔内圧 (mITP)
- この論文では、食道バルーン法を用いて推定した胸腔内圧を、右房圧から引くことで算出しています。ではなぜ「差」を見るのでしょうか?
- 心房にある容量受容体は、絶対的な圧力(RAP)ではなく心房壁の「伸展」を感知して反応します。
- 通常の状態: 静脈還流が増えて心房が膨らむと、壁が伸展し(ATPG上昇)、受容体が刺激されてAVP(バソプレシン)の分泌が抑制されます(水利尿が起こる)
- ATPGの重要性: たとえ心房内の圧力(RAP)が高くても、同時に心房の外側からの圧力(胸腔内圧)も高ければ、心房壁は外から圧迫される形になり、十分に進展できません。つまり、「見かけ上の圧(RAP)」は高くても、「実質的な壁の張り(ATPG)」は低いという現象が起こります。
- よって ATPGの値が低下すると、たとえ中心静脈圧が高くても胸腔内圧が高ければ、身体は「脱水・容量不足」と判断し、AVPを分泌して水を溜め込もうとします。
なぜ心不全ではADH分泌が抑制されないのか
- そもそも知らなかったのですが、心不全患者では血漿AVPレベルが一般的に上昇していることが示されています(Verbrugge et al. JACC. 2015)。常識なのかもしれませんが、私は「なぜ、体液が貯留しているであろう心不全でAVPが分泌されてしまうのだろうか・・・?」と疑問に思っていました。
- 心不全では「低い浸透圧でもダラダラ出る(閾値低下:スイッチが入る基準が甘くなる)」上に、「血液不足と勘違いしてドバっと出る(非浸透圧性刺激)」という2つの分泌異常があるためです。以下の論文の解説がわかりやすいです。
- Verbrugge, F, Steels, P, Grieten, L. et al. Hyponatremia in Acute Decompensated Heart Failure: Depletion Versus Dilution. JACC. 2015 Feb, 65 (5) 480–492.
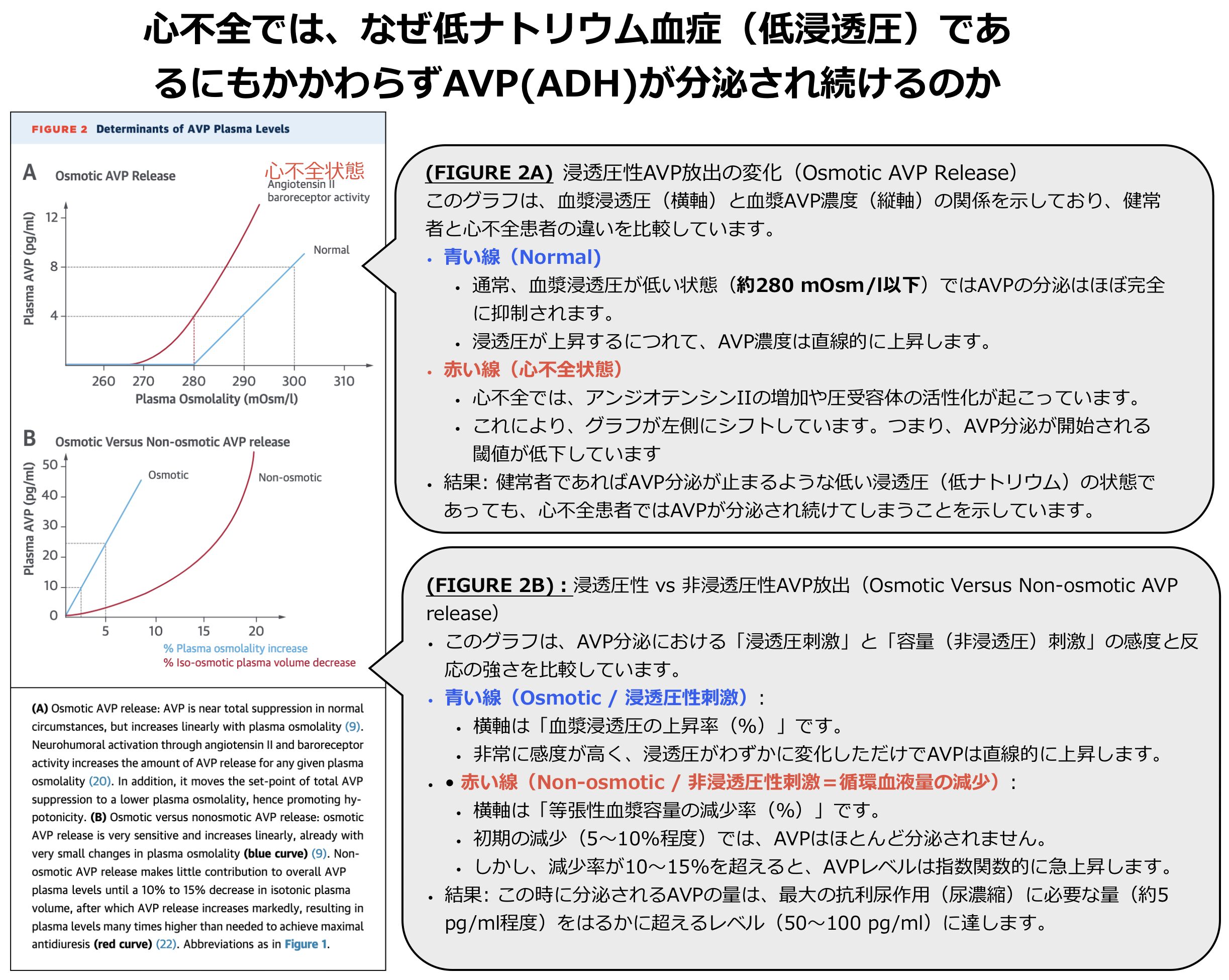
- 通常であれば、低浸透圧になるとAVPの分泌は止まるはずですが、心不全ではその生理的なブレーキが効かなくなっています。その理由は、身体が「浸透圧」よりも「血液の量」の維持を優先するという、「浸透圧調節の破綻」が生じているためです。
具体的には、上記図解のようにの2つの理由によりAVPが高値となります。
■浸透圧感受性の亢進(スイッチが入る基準が甘くなる)
- アンジオテンシンIIや圧受容体からの刺激は、AVPを出すための「セットポイント(閾値)」を下げてしまいます。
- 通常ならAVP分泌が完全に止まるような低い浸透圧レベルであっても、心不全患者ではスイッチが切れず、AVPが分泌され続ける状態になっています(Figure 2A)。
- また、わずかな浸透圧の変化に対しても過敏に反応してAVPを出すようになります。
■非浸透圧性分泌(身体が「血液不足」と勘違いしてADHがドバっと出る)
- これが最も強力な要因です。心不全では心拍出量が低下しているため、動脈を流れる「有効循環血液量」が減少しています。
- 身体(圧受容体)はこれを「出血や脱水で血液が足りない!」と感知し、アンジオテンシンIIの増加や交感神経の興奮を引き起こします。
- これらは強力な刺激となって、血漿浸透圧が低いことなどお構いなしに、AVPを指数関数的に大量に分泌させます(Figure 2Bの赤い線)。
- この反応は、浸透圧による抑制(青い線)を完全に凌駕してしまうため、低ナトリウム血症でもAVPが出続けます。
ADHの臨床上の解釈
ADHの絶対値だけでは評価できないため、必ず血漿浸透圧(または血清Na、血糖、BUNから計算)を同時に測定する必要があります。また、日内変動や体位の影響を受けるため、原則として早朝空腹時、約30分の臥位安静後に採血を行います
上述のようにADHは浸透圧の影響を受けます。よって基準値というものはなく、常に血漿浸透圧との相対的な関係で評価します。
1. 血漿浸透圧が高い(>290-300 mOsm/kg)場合
◦ ADHが高値: 正常な生理的反応です(脱水など)。
◦ ADHが低値: 中枢性尿崩症(ADHを分泌できない)が疑われます。
2. 血漿浸透圧が低い(<275-280 mOsm/kg)場合
◦ ADHが低値: 正常な反応です(水中毒などによる生理的抑制)。
◦ ADHが基準値内~高値(測定感度以上): 本来抑制されるべきADHが分泌されているため、SIADH(ADH不適切分泌症候群)の可能性が高くなります。ただし、心不全や肝硬変などの有効循環血液量が低下する病態(ADH分泌刺激が存在する状態)を除外する必要があります。▶また低ナトリウム血症の記事で解説しようと思います。
このように、ADHの測定結果は「その時の浸透圧に対して適切か不適切か」という視点で解釈することが重要です。
参考文献
- Bárez-López, Soledad, Liam Scanlon, David MurphyとMichael Paul Greenwood. 「Imaging the Hypothalamo-Neurohypophysial System」. Neuroendocrinology 113, no. 2 (2023年): 168–78. https://doi.org/10.1159/000519233.
- Boone, Michelle, とPeter M. T. Deen. 「Physiology and Pathophysiology of the Vasopressin-Regulated Renal Water Reabsorption」. Pflügers Archiv – European Journal of Physiology 456, no. 6 (2008年): 1005–24. https://doi.org/10.1007/s00424-008-0498-1.
- Kanbay, Mehmet, Sezen Yilmaz, Neris Dincer, ほか. 「Antidiuretic Hormone and Serum Osmolarity Physiology and Related Outcomes: What Is Old, What Is New, and What Is Unknown?」 The Journal of Clinical Endocrinology & Metabolism 104, no. 11 (2019年): 5406–20. https://doi.org/10.1210/jc.2019-01049.
- Kaufmann, Horacio, Lucy Norcliffe-KaufmannとJose-Alberto Palma. 「Baroreflex Dysfunction」. New England Journal of Medicine 382, no. 2 (2020年): 163–78. https://doi.org/10.1056/NEJMra1509723.
- Lowell. 「New Neuroscience of Homeostasis and Drives for Food, Water, and Salt」. New England Journal of Medicine, advance online publication, 2019年. https://doi.org/10.1056/NEJMra1812053
- Moritz, Michael L., とJuan C. Ayus. 「Maintenance Intravenous Fluids in Acutely Ill Patients」. New England Journal of Medicine 373, no. 14 (2015年): 1350–60. https://doi.org/10.1056/NEJMra1412877.
- Solis-Herruzo, JoséA., Diego Moreno, Amelia Gonzalez, ほか. 「Effect of Intrathoracic Pressure on Plasma Arginine Vasopressin Levels」. Gastroenterology 101, no. 3 (1991年): 607–17. https://doi.org/10.1016/0016-5085(91)90516-N.
- Verbrugge, Frederik H., Paul Steels, Lars Grieten, Petra Nijst, W. H. Wilson TangとWilfried Mullens. 「Hyponatremia in Acute Decompensated Heart Failure」. Journal of the American College of Cardiology 65, no. 5 (2015年): 480–92. https://doi.org/10.1016/j.jacc.2014.12.010.



コメント